

【滴定】定義和原理
滴定法是古老的分析方法之一,在多行業(yè)都有應(yīng)用。例如,可用于分析飲用水,也可確定電池材料中的金屬含量。
什么是滴定?
滴定法用于測定樣品溶液中待分析物的濃度。在樣品中加入已知濃度的標準溶液(滴定劑),滴定劑和被分析物發(fā)生化學(xué)反應(yīng),通過滴定劑的消耗體積、濃度和樣品的量來計算待分析物濃度。滴定中的常用術(shù)語(按字母順序排列)及其定義見下表。

如何進行滴定?
1.滴定劑標定
滴定劑需要先進行標定,才能獲得滴定劑的準確濃度,也提高了結(jié)果的準確性。
2.樣品制備
如果進行滴定,樣品應(yīng)該是溶液。因此,如果是固體樣品,需要先溶解或預(yù)處理來釋放出被分析物質(zhì)(例如,通過消解、萃取或灰化過程)。有時還需要添加輔助溶液。例如,氧化還原滴定通常需要在特定的 pH 值下進行。間接滴定需要輔助溶液,因為某些分析物不能直接與滴定劑反應(yīng),可預(yù)先通過其它反應(yīng)使其轉(zhuǎn)變成能與滴定劑定量反應(yīng)的產(chǎn)物,間接測定其含量。對于返滴定來說,要先加入過量的試劑。這種試劑會與被分析物發(fā)生反應(yīng),然后對過量的試劑進行滴定。
3.滴定
在滴定過程中,樣品溶液的攪拌非常重要。這樣可以確保滴定劑和被分析物充分混合。滴定劑加入樣品,使其余樣品充分反應(yīng),到達滴定終點。手動滴定使用顏色指示劑來確定終點。自動電位滴定儀使用電極來檢測等當(dāng)點。將滴定劑的體積與測量到的信號進行對比,即可得到滴定曲線。圖1 顯示了含有碳酸鹽雜質(zhì)的酸堿滴定曲線。
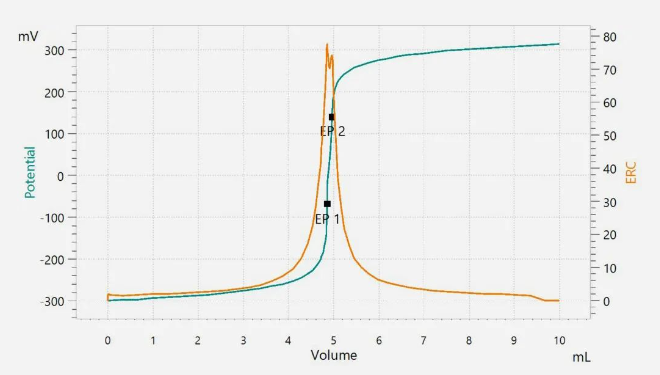
圖1. 用鹽酸滴定氫氧化鋰的滴定曲線。第一個等當(dāng)點(EP1)對應(yīng)氫氧化物,第二個等當(dāng)點(EP2)對應(yīng)碳酸鹽雜質(zhì)。
4.結(jié)果計算
滴定結(jié)束后,要計算滴定結(jié)果。自動電位滴定儀會自動進行計算。

根據(jù)結(jié)果的單位,計算公式會有所不同。

